中国科大附一院揭示脂多糖结合蛋白抵抗肝脏氧化应激机制
年龄的增长和体重的增加都会给身体细胞带来压力,主要表现为活性氧自由基(ROS)的过度生成。在氧化应激条件下,过量的ROS会破坏细胞蛋白、脂质和DNA,对细胞造成致命损伤,进而导致与肥胖和衰老相关的代谢疾病,比如糖尿病和脂肪肝。虽然抗氧化剂和ROS清除剂可以缓解代谢功能障碍,并且一些抗氧化剂已经在临床环境中进行了试验,但长期抗氧化治疗存在潜在的安全问题,目前还没有理想的药物可用。因此,了解氧化应激导致的脂质代谢功能障碍的分子机制至关重要。
4月13日,中国科大附一院(安徽省立医院)内分泌科叶山东、郑茂团队联合安徽医科大学基础医学院方皓舒教授团队在《自然通讯(Nature Communications)》发表题为《脂多糖结合蛋白通过调节脂滴稳态抵抗肝脏氧化应激压力(Lipopolysaccharide binding protein resists hepatic oxidative stress by regulating lipid droplet homeostasis)》的研究论文,首次提出“氧化应激躲避”的概念,原创性报道机体调控氧化应激压力全新机制,为理解细胞如何应对氧化应激提供了新见解,为对缓解氧化应激引起的代谢功能障碍及基于氧化还原平衡调控的新治疗策略开发提供了新思路,也为代谢性疾病的预防和治疗提供了新方向。

代谢相关性脂肪肝病是一种以肝细胞内甘油三酯积累为主要特征的病变,主要表现为脂滴的积累。脂滴作为脂质储存的主要细胞器,正常情况下,脂滴主要发挥调节能量代谢的作用。
在氧化应激下,脂滴作为细胞“氧化应激躲避”的关键细胞器之一,积累大量易受ROS攻击的不饱和甘油三酯(UFA-TG)以防止进一步过氧化,从而维持脂质稳态。然而,氧化应激下发生“氧化应激躲避”的分子机制尚不清楚,UFA-TG的细胞分选机制急需阐明。
该研究指出,当细胞处于氧化应激状态时,脂多糖结合蛋白(LBP)的表达水平会增加,并聚集在脂滴中。LBP具有脂质捕获活性,通过其C端的疏水结构捕获脂质,并将其运送至脂滴,从而控制脂质-氧化稳态。研究人员还发现,还原剂N-乙酰-L-半胱氨酸处理可以清除细胞内的活性氧并增加磷脂合成。磷脂可以与甘油三脂竞争性结合LBP,促进LBP转运出脂滴并促进脂解。但是,在氧化应激未消除的环境下,使用磷脂治疗脂肪肝可能造成更严重的肝细胞损伤。PRDX4作为细胞氧化还原信号的感应器,通过与LBP互作来调控LBP/甘油三酯的脂滴穿梭过程,维持细胞氧化还原稳态。此外,长期的压力刺激应激会上调LBP表达,进而导致胰岛素抵抗和肥胖。
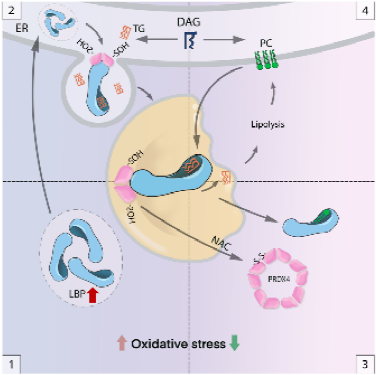
LBP响应氧化应激维持脂滴稳态工作模式图
图注:1.LBP响应氧化应激并表达上调;2. LBP从ER转移到LD以促进LD增长;3. 氧化应激消退后PRDX4的进入分解再生途径从而促进LBP离开LDs;4. LBP离开LDs并增强脂解和磷脂合成。
这项研究成果揭示了氧化应激诱导脂质积累的机制。脂多糖结合蛋白作为一种抗氧化剂和“氧化应激躲避”的核心分子,是连接压力-氧化应激-代谢紊乱-肥胖的重要枢纽。其与脂质代谢和氧化还原信号通路相连接,精确地维持细胞内稳态以适应氧化应激。抗氧化疗法是一种治疗由脂多糖结合蛋白引起肥胖的潜在方法。
中国科大附一院内分泌科糖尿病研究室博士研究生张启伦、安徽医科大学基础医学院博士研究生沈徐婷、硕士研究生袁欣为本文的共同第一作者;中科大附一院内分泌科糖尿病研究室叶山东教授、郑茂主任,安徽医科大学基础医学院方皓舒教授为本文的共同通讯作者;来自华中科技大学同济医院、图书馆VIP、国家蛋白质中心的多位专家教授也为该项目研究做出了重要贡献。该研究获得国家自然科学基金、安徽省地方科技发展专项基金、科大新医学基金等经费支持。
论文链接:https://www.nature.com/articles/s41467-024-47553-5
(附属第一医院、生医部、科研部)